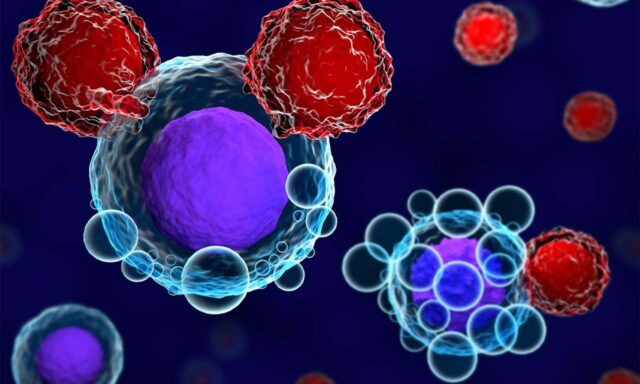
Επιστήμονες του Πανεπιστημίου της Καλιφόρνιας στο Ντέιβις και του Πανεπιστημίου της Ιντιάνα εξετάζουν μια πρωτοποριακή προσέγγιση που θα φέρει επανάσταση στη θεραπεία του καρκίνου. Στην ουσία, χτυπούν στρατηγικά τις “πόρτες” που οδηγούν στην καρδιά των καρκινικών όγκων. Το κλειδί βρίσκεται σε μια εξελιγμένη μέθοδο που περιλαμβάνει μια “ωρολογιακή βόμβα”, η οποία όταν ενεργοποιηθεί ανοίγει σημεία πρόσβασης μέσα στον όγκο για αποτελεσματικότερες φαρμακευτικές θεραπείες.
Η καινοτόμος στρατηγική επικεντρώνεται στον χειρισμό των κυττάρων που επενδύουν τα αιμοφόρα αγγεία που σχετίζονται με έναν όγκο, τα οποία ελέγχουν την είσοδο στον ιστό του όγκου. Τα τροποποιημένα ανοσοποιητικά κύτταρα, ζωτικής σημασίας για την καταπολέμηση του καρκίνου, αγωνίζονται να διεισδύσουν στον όγκο έως ότου ανοίξουν αυτά τα αγγεία. Η “ωρολογιακή βόμβα” σε αυτή την προσέγγιση είναι ένας υποδοχέας “θανάτου” γνωστός ως Fas (ή CD95). Ενεργοποιούμενος από ένα ειδικό αντίσωμα, ο Fas εκκινεί τον προγραμματισμένο κυτταρικό θάνατο.
Είναι αξιοσημείωτο ότι μέχρι πρόσφατα, ο Fas είχε αγνοηθεί στην ανοσοθεραπεία του καρκίνου, χωρίς κανένα αντίσωμα Fas να φτάσει σε κλινικές δοκιμές. Ωστόσο, πρόσφατα πειράματα επιστημόνων του Πανεπιστημίου της Καλιφόρνιας στο Ντέιβις, χρησιμοποιώντας μοντέλα ποντικιών και ανθρώπινες κυτταρικές γραμμές, εντόπισαν συγκεκριμένα αντισώματα που όταν προσκολλώνται στους υποδοχείς Fas πυροδοτούν την αυτοκαταστροφή με ελεγχόμενο τρόπο.
Ο ανοσολόγος και κύριος συγγραφέας της μελέτης, Jogender Tushir-Singh, εξηγεί: “Οι προηγούμενες προσπάθειες για τη στόχευση αυτού του υποδοχέα ήταν ανεπιτυχείς. Όμως, τώρα που εντοπίσαμε αυτόν τον επίτοπο, θα μπορούσε να υπάρξει μια θεραπευτική πορεία προς τα εμπρός για τη στόχευση του Fas στους όγκους”.
Το αναγνωρισμένο αντίσωμα λειτουργεί ουσιαστικά ως “διακόπτης θανάτου” για το κύτταρο, επιτρέποντας σε άλλες θεραπείες καρκίνου, όπως η θεραπεία CAR-T, να αποκτήσουν πρόσβαση σε κρυμμένους στόχους εντός του όγκου. Η θεραπεία CAR-T περιλαμβάνει τον προγραμματισμό των Τ-κυττάρων του ίδιου του ασθενούς ώστε να επιτίθενται σε συγκεκριμένα καρκινικά κύτταρα. Ωστόσο, αυτά τα τροποποιημένα κύτταρα συχνά δυσκολεύονται να διεισδύσουν στα μικροπεριβάλλοντα των συμπαγών όγκων, με αποτέλεσμα την περιορισμένη επιτυχία κατά των εν λόγω καρκίνων.
Ο Tushir-Singh υπογραμμίζει τη σημασία της δημιουργίας χώρων για τη διείσδυση των Τ-κυττάρων στους συμπαγείς όγκους, δηλώνοντας: “Δεν έχει σημασία πόσο καλά κατασκευάζουμε τα αντισώματα και τα Τ-κύτταρα που ενεργοποιούν τους ανοσοποιητικούς υποδοχείς αν δεν μπορούν να πλησιάσουν τα κύτταρα του όγκου”.
Σε πρόσφατα πειράματα, οι επιστήμονες του Πανεπιστημίου της Καλιφόρνιας στο Ντέιβις ανέπτυξαν δύο τροποποιημένα αντισώματα που προσκολλώνται αποτελεσματικά στους υποδοχείς Fas, προκαλώντας την αυτοκαταστροφή των παρακείμενων κυττάρων. Η επιτυχία αυτή παρατηρήθηκε σε μοντέλα καρκίνου των ωοθηκών και σε διάφορες κυτταρικές γραμμές όγκων που δοκιμάστηκαν στο εργαστήριο.
Ο σύνδεσμος Fas που αναπτύχθηκε εμπλέκει δύο κρίσιμα μέρη του υποδοχέα Fas, αποκαλύπτοντας πιθανούς φαρμακευτικούς στόχους για μελλοντικές έρευνες. Με τη μηχανική ανάπτυξη CAR-T κυττάρων ώστε να στοχεύουν αυτά τα μέρη του υποδοχέα στα παραμένοντα κύτταρα, η θεραπεία θα μπορούσε να γίνει σημαντικά πιο αποτελεσματική κατά των συμπαγών όγκων.
Ο Tushir-Singh προτείνει: “Θα πρέπει να γνωρίζουμε την κατάσταση Fas ενός ασθενούς – ιδιαίτερα τις μεταλλάξεις γύρω από τον επίτοπο που ανακαλύφθηκε – πριν καν σκεφτούμε να του δώσουμε CAR-T”. Η προσέγγιση αυτή όχι μόνο λειτουργεί ως οριστικός δείκτης για την αποτελεσματικότητα της θεραπείας CAR-T, αλλά θέτει επίσης τις βάσεις για την ανάπτυξη αντισωμάτων που ενεργοποιούν επιλεκτικά το Fas, σκοτώνοντας αποτελεσματικά τα καρκινικά κύτταρα και υποστηρίζοντας ενδεχομένως τη θεραπεία με CAR-T-κύτταρα σε συμπαγείς όγκους.